De Aldehydoksidase er et enzym som bryter ned aldehyder i virveldyr. Det finnes i forskjellige vev fra pattedyr og mennesker. Den nøyaktige funksjonen til aldehydoksydasen er ennå ikke kjent.
Hva er aldehydoksidase?
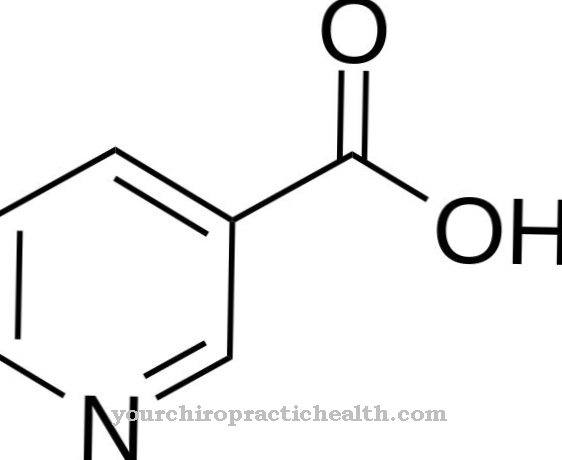
Aldehyde oxidase (AOX1) hjelper med enzymatisk nedbrytning av aldehyder i kroppen. Det ble imidlertid funnet at det også bryter ned nikotin til kotinin. Et oksygenatom er bygget inn i det oksygenfrie nikotinet for å danne en aldehydstruktur.
På grunn av dette faktum er aldehydoksydasen også viktig for tryptofanmetabolismen og samtidig for biotransformasjonen. Det finnes hovedsakelig i cytosol i levercellene, bukspyttkjertelen, lungene, skjelettmusklene eller fettcellene. Kofaktormolybden er veldig viktig for aktiviteten til enzymet. Det er bare ett AOX-gen i humant DNA som kan kode for et funksjonelt enzym. Flere AOX-gener er aktive i andre virveldyr. Aldehyde oksydase er veldig lik og relatert til enzymet xanthine dehydrogenase.
Begge enzymer kan omdanne hypoksantin til xantin ved å absorbere et oksygenatom og et vannmolekyl. Konvertering av xantin til urinsyre foregår imidlertid bare gjennom xantinhydrogenase (xantinoksidase). Aldehydoksidasen består av 1338 aminosyrer. Molybdopterin, FAD og 2 (2Fe2S) fungerer som kofaktorer for deres effektivitet. Reaksjonen som allerede er karakterisert ved navnet, karakteriserer omdannelsen av aldehyder med tilsetning av oksygen og vann til karboksylsyrer og hydrogenperoksyd.
Funksjon, effekt og oppgaver
Enzymet aldehydoksydase katalyserer flere reaksjoner. For det meste er det ansvarlig for omdannelsen av aldehyder til karboksylsyrer med tilsetning av oksygen og vann. Generelt formidler aldehydoksidase tilsetningen av et oksygenatom til et substrat.
Blant annet katalyserer det også omdannelsen av nikotin til conitin. Derfor spiller det også en viktig rolle i biotransformasjon og tryptofan metabolisme. Molybden er alltid nødvendig som en kofaktor i disse reaksjonene. Som en del av biotransformasjonen konverterer den xenobiotika med aldehydgrupper til de tilsvarende karboksylsyrene i fase I-reaksjonen. I fase II-reaksjonen er glukuronsyre festet til karboksylgruppene for å øke vannløseligheten for å skylle det fremmede molekylet ut av kroppen.
Strukturelt og kjemisk er aldehydoksydase nært beslektet med det homologe enzymet xanthinhydrogenase (xantinoksydase). Det er imidlertid ikke kjent hvorfor omdannelsen av xantin til urinsyre med tilsetning av oksygen og vann bare katalyseres av xantinoksydase. Konverteringen av hypoksantin til xantin katalyseres fortsatt av begge enzymer. Videre er aldehydoksidase også ansvarlig for adipogenese (reproduksjon av fettceller).
Det stimulerer sekresjonen av vevshormonet adiponectin. Adiponectin øker på sin side effektiviteten av insulin. I hepatocyttene hemmer adiponectin igjen frigjøring av aldehydoksidase. En mangel på aldehydoksidase (AOX1) hemmer også lipideksport fra cellene. Den nøyaktige funksjonen til aldehydoksydase er ennå ikke helt forstått.
Utdanning, forekomst, egenskaper og optimale verdier
Aldehydoksidase finnes hovedsakelig i cytoplasma av leverceller. Imidlertid finnes det også i fettceller, lungevev, skjelettmuskulatur og bukspyttkjertelen. Det pleide å forveksles med den homologe xantinoksidasen.
Begge enzymer har en lignende struktur. Noen ganger katalyserer de imidlertid forskjellige reaksjoner. Begge enzymer trenger de samme kofaktorene for sin funksjon. Disse er molybdopterin, FAD og 2 (2Fe2S). Imidlertid nedbryter aldehydoksydase ikke bare aldehyder, men er også ansvarlig for oksidasjonen av N-heterocykliske forbindelser som nikotin til kotinin.
Sykdommer og lidelser
Sammen med xantindhydrogenase (xantinoksydase) og sulfittoksydase er aldehydoksidase avhengig av kofaktormolybden. Molybden er bygget inn i et molybdopterin som et komplekst atom og danner molybden kofaktor. Når det gjelder molybdenmangel, fungerer disse tre enzymene dårlig.
Xanthine dehydrogenase katalyserer nedbrytningen av xanthine til urinsyre. Enzymet aldehydoksydase er bare delvis involvert i denne prosessen, for eksempel når hypoksantin brytes ned til xantin. Her konkurrerer den til og med xantinoksidase. Derfor er det ingen isolert aldehydoksidase-mangel. Imidlertid støtter aldehydoksidase nedbrytningen av katekolaminer. Sulfittoksydasen er ansvarlig for nedbrytningen av svovelholdige aminosyrer som cystein, taurin eller metionin. Hvis dette enzymet er mangelfull, omdannes sulfitt ikke lenger til sulfat. På grunn av kofaktormolybden har de tre enzymer vanligvis en vanlig mangel.
Selvfølgelig er isolerte defekter på grunn av mutasjoner mulig for hver av disse enzymene. Imidlertid har ingen kliniske bilder med en spesifikk aldehydoksidase-mangel blitt beskrevet så langt. En molybdenmangel indusert av et ubalansert kosthold er svært sjelden. Imidlertid kan dette skje med parenteral ernæring som er lav i molybden i mer enn seks måneder. I slike tilfeller er tachypnea, takykardi, alvorlig hodepine, kvalme, oppkast, sentral ansiktshindring eller koma. Videre er det intoleranser for visse aminosyrer. Forhøyede sulfittkonsentrasjoner finnes i urinen, mens reduserte urinsyreverdier finnes i blodet.
Hvis molybdenmangel vedvarer, kan det føre til problemer med nedbrytning av svovelholdige aminosyrer, sulfittallergier, hårtap, lave urinsyrenivåer i blodet og fruktbarhetsproblemer. De fleste av symptomene skyldes imidlertid sulfittoksydase og xantindhydrogenasemangel. Takykardien skyldes sannsynligvis økte nivåer av adrenalin eller noradrenalin (katekolaminer), da nedbrytningen av dem blir forsinket av mangel på aldehydoksidase. En molybdenmangel kan være forårsaket av et kosthold som er ekstremt lite i molybden og i inflammatoriske tarmsykdommer som Crohns sykdom med malabsorpsjon av mat.
En arvelig molybden-kofaktormangel på grunn av nedsatt syntese av molybdopterin er dødelig hvis alle tre enzymer mislykkes uten behandling.

.jpg)

.jpg)


.jpg)




.jpg)



.jpg)