trypsin Som et enzym i bukspyttkjertelen er det ansvarlig for den videre nedbrytningen av matproteiner. Det fungerer i det sterkt alkaliske området. Trypsinmangel fører til proteinmangel i kroppen på grunn av nedsatt proteinfordøyelse.
Hva er trypsin?
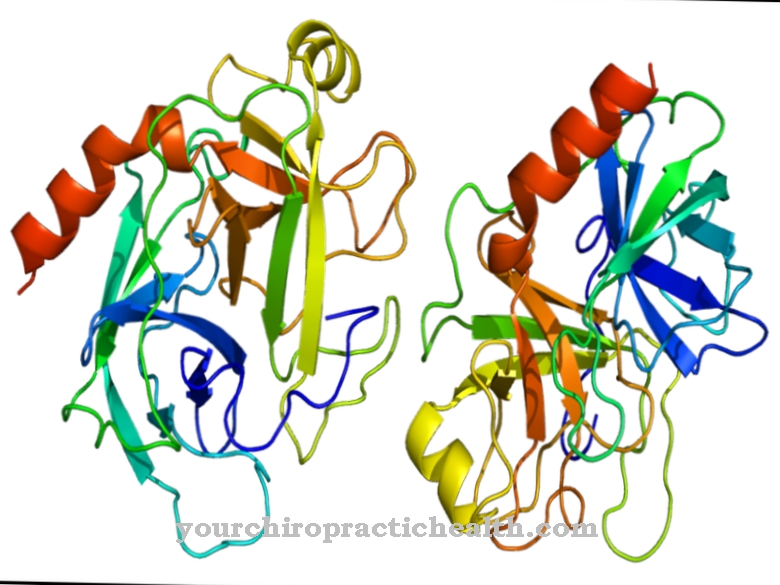
Trypsin er en protease som fortsetter nedbrytningen av proteiner i det alkaliske området i tynntarmen. I magen begynner proteinnedbrytning i det sure miljøet av enzymet pepsin. Enzymet trypsin består av tre komponenter.
Disse er trypsin-1 som kation, trypsin-2 som anion og trypsin-4. To tredjedeler av enzymet består av trypsin-1 og en tredjedel av trypsin-2. Trypsin-4 eller mesotrypsin finnes bare i små mengder. Trypsin er en endoprotease. Det deler bare opp et protein noen steder. Det er også en serinprotease. Det aktive senteret inneholder den katalytiske triaden av asparaginsyre, histidin og serin. Den deler kostholdsproteinene fortrinnsvis ved de basiske aminosyrene lysin, arginin og modifisert cystein.
Trypsin produseres fra zymogenforløperen trypsinogen ved hjelp av den katalytiske virkningen av tarmenszymet enteropeptidase. Enzymet består av 224 aminosyrer. Trypsin utvikler sin optimale effekt ved en pH-verdi på 7 til 8.
Funksjon, effekt og oppgaver
Oppgaven med trypsin er å fortsette nedbrytningen av proteiner som allerede har startet i magen i det alkaliske området. I magen begynner for-fordøyelsen av matproteiner av det lignende enzymet pepsin i det sure området.
Også her brytes proteinkjedene på visse punkter. Mens denne splitting av proteinene foregår i magen på aromatiske aminosyrer som fenylalanin, blir proteinene og polypeptidene delt av trypsin på de basiske aminosyrene lysin og arginin så vel som på det modifiserte cystein. En annen forskjell for pepsin er at trypsin utvikler sin optimale effekt i det alkaliske området ved en pH-verdi på 7 til 8. Aktivert trypsin konverterer også andre zymogener som chymotrypsinogen, pro-elastase, procarboxypeptidase og andre inaktive enzymer til aktive enzymer.
Konverteringen begynner umiddelbart etter utgivelsen av trypsin. De andre proteasene i bukspyttkjertelen er chymotrypsin, karboksypeptidase eller elastin. Videre aktiverer trypsin seg selv ved å konvertere trypsinogen. Enker i bukspyttkjertelen er i utgangspunktet i sin inaktive form for ikke å bryte ned bukspyttkjertelen gjennom selvfordøyelse. Først når de inaktive preformene skilles ut, kan de aktiveres ved å splitte. For det første katalyseres omdannelsen av trypsinogen til trypsin ved enteropeptidase. Det er den eneste funksjonen til enteropeptidase.
En heksamer med det terminale aminosyrelysinet blir delt fra trypsinogen. Siden trypsin også splitter polypeptidkjeder på det basale lysinet, katalyserer det nå også sin egen aktivering og samtidig aktiveringen av de andre zymogenene. Sammen med enzymene chymotrypsin og elastase, deler den opp større proteiner i tynntarmen og peptonene (polypeptidkjeder) produsert ved virkning av pepsin i tri- og dipeptider. Disse mindre peptidene blir deretter brutt ned videre til aminosyrer ved hjelp av andre enzymer. Trypsin bidrar spesielt til nedbrytning av aminosyren metionin. Lysin stimulerer blant annet dannelsen av trypsin.
Utdanning, forekomst, egenskaper og optimale verdier
Trypsin er et endogent enzym som brukes til å fordøye matproteiner. Derfor blir det alltid utskilt av bukspyttkjertelen like etter å ha spist. Imidlertid kan enzymet også oppnås fra dyrekilder og brukes medisinsk. Den proteinsplittende effekten kan blant annet brukes til å bryte ned kroppens egne proteinkomplekser. Slik kan immunkomplekser løses ved autoimmune sykdommer.
Betennelse i muskel- og skjelettsystemet kan også behandles godt med trypsin. Den aktiverer også enzymet plasmin fra plasminogen. Plasmin løser opp fibrin når det er sterk trombedannelse. Ved hjelp av trypsin kan trombose behandles eller til og med forhindres. Videre støtter trypsin fordøyelsen når den tas under måltidene. Når det påføres 1 til 2 timer før eller etter et måltid, utfolder det seg antiinflammatoriske effekter.
Sykdommer og lidelser
I sammenheng med mangel på bukspyttkjertelen kan syntesen av fordøyelsesenzymer som trypsin begrenses. Konsekvensen er utviklingen av fordøyelsesbesvær. I tillegg til proteaser, produserer bukspyttkjertelen også lipaser og amylaser.
Hvis enzymene mangler, fordøyes ikke matkomponentene lenger og havner i tykktarmen. For eksempel, hvis det er mangel på trypsin, kan proteinet i kostholdet ikke lenger fordøyes ordentlig. Putrefaktive bakterier legger seg i tykktarmen og bryter ned proteinene anaerobt. Det er store fordøyelsesproblemer med flatulens, diaré og magesmerter. Videre fører den reduserte dannelsen av aminosyrer til proteinmangel og underernæring til tross for tilstrekkelig matinntak. Imidlertid kan enzymene også tilføres utenfra.
Imidlertid er det også medisinske nødsituasjoner der kroppens egne enzymer som trypsin fordøyer selve bukspyttkjertelen. Dette kan skje hvis galleveiene og bukspyttkjertelen kan blokkeres. Trypsin frigjøres, men kan ikke komme inn i tynntarmen gjennom blokkeringen av bukspyttkjertelen. Hvis bukspyttkjertelen ikke åpnes i denne akutte nødsituasjonen, vil utfallet være dødelig på grunn av selvoppløsningen av bukspyttkjertelen. Selv med svulster i bukspyttkjertelen kan bukspyttkjertelen være helt eller delvis lukket. Handlingen til fordøyelsessaftene i bukspyttkjertelen manifesterer seg som kronisk eller akutt pankreatitt.
Mangel på trypsin kan også være forårsaket av en mutasjon. Det er også arvelige former for pankreatitt når nedbrytningen av trypsin forstyrres.



.jpg)

.jpg)

.jpg)




.jpg)



.jpg)