Omtrent halvparten av alle proteiner er i menneskekroppen glykoproteiner. Stoffene spiller en rolle som cellekomponenter så vel som immunstoffer. De er hovedsakelig dannet som en del av den såkalte N-glykosyleringen og kan forårsake alvorlige sykdommer hvis de ikke er satt sammen riktig.
Hva er glykoproteiner?
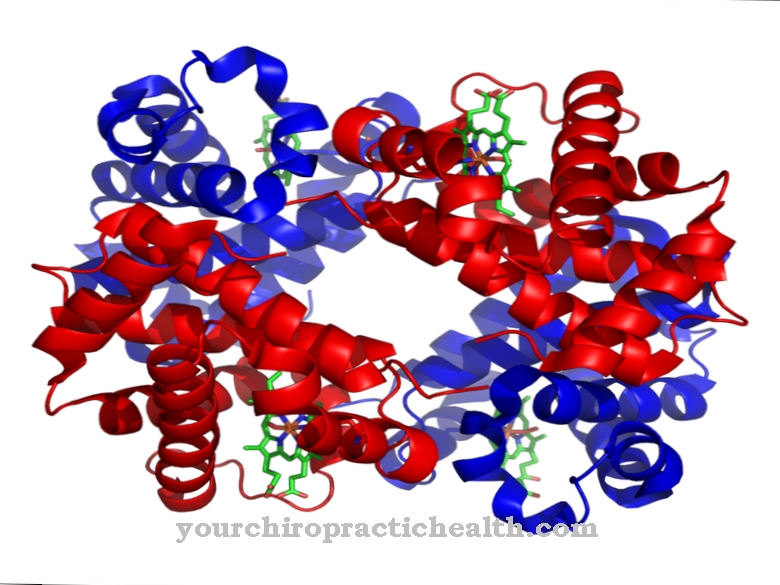
Glykoproteiner er proteiner med trelignende forgrenede heteroglykanrester. De har vanligvis en tyktflytende konsistens. Makromolekylene inneholder kovalent bundne sukkergrupper.
De består av monosakkarider som glukose, fruktose, mannose eller acetylert aminosukker. Derfor er de også kjent som proteinbundne oligosakkarider. Den kovalente bindingen kan finne sted på forskjellige måter og tilsvarer enten en binding til aminosyrene serin eller asparagin. Bindingen til serin kalles O- og den til asparagin N-glykosylering. Glykoproteinene involvert i N-glykosylering varierer i størrelse. De tilsvarer monosakkarider, di- eller oligosakkarider og til og med polysakkarider.
I henhold til deres andel monosakkarider er de delt inn i høye mannose, komplekse og hybridglykoproteiner. I den mannoserike gruppen dominerer mannoserester. I den sammensatte gruppen dominerer sakkarider. Hybridgruppen er en hybrid. Karbohydratinnholdet i glykoproteiner er mellom noen få prosent for ribonukleaser og opptil 85 prosent for blodgruppeantigener.
Funksjon, effekt og oppgaver
Glykoproteiner har mange funksjoner i den menneskelige organismen. De er en strukturell komponent av cellemembraner og blir også referert til som strukturelle proteiner i denne sammenhengen. De finnes også i slim og brukes som smøremidler i væsker.
Som membranproteiner bidrar de til celleinteraksjon. Noen glykoproteiner har også hormonelle funksjoner, for eksempel vekstfaktoren hCG. Stoffene er like viktige som immunologiske komponenter i form av immunoglobuliner og interferoner. Alle eksportproteiner og membranproteiner i kroppen var fremdeles glykoproteiner, i det minste under biosyntese. De er spesielt relevante for gjenkjennelsesreaksjonene i immunsystemet, ettersom de interagerer med immunologiske T-celler og T-cellereseptorer. Ulike plasmaproteiner er blitt isolert i humant blodplasma, hvorav bare albumin og prealbumin ikke har sukkerrester.
Overfloden av glykoproteiner er fantastisk. Til syvende og sist inneholder nesten alle ekstracellulært oppløselige proteiner og enzymer sukkerrester. Som hormoner har glykoproteiner en pleiotropisk effekt og er derfor avgjørende for aktiviteten til forskjellige organsystemer. Hormonene TSH, HCG og FSH er for eksempel glykoproteiner. Som membranproteiner er de representert i rollen som reseptorer, så vel som transportører og stabilisatorer. De har en stabiliserende effekt, spesielt sammen med glykolipider. Sammen med disse stoffene danner de den såkalte glykokalksen, som stabiliserer celler uten en cellevegg.
Utdanning, forekomst, egenskaper og optimale verdier
Den vanligste dannelsen av glykoproteiner er N-glykosidbindingen eller N-glykosylering til asparagin. Sukker binder seg til de nitrogenfrie syreamidgruppene. N-glykosylering foregår i endoplasmatisk retikulum. De således dannede N-glykosidene er den mest relevante glykoproteingruppen.
Ved N-glykosylering snytetiserer sukkerforløperen seg på bærermolekylet dolichol, uavhengig av aminosyresekvensen til målproteinet. OH-gruppen på slutten av molekylet er koblet med difosfat. En oligosakkaridforløper dannes ved den terminale fosfatresten av molekylene. De syv første av sukkerene samles på den cytosoliske siden. To N-acetyl-glukosaminer og fem manose-rester er festet til dolichol-fosfat. Sukkernukleotidene BNP-mannose og UDP-N-acetyl-glukosamin fremstår som givere. Forløperen transporteres gjennom ER-membranen via et transportprotein.
Forløperen er således orientert mot innsiden av endoplasmatisk retikulum, hvor fire mannoserester blir lagt til den. I tillegg dyrkes glukoserester. Den 14 sukker lange forløperen overføres til slutt til et protein. En annen formasjonsvei for glykoproteiner er O-glykosidbindingen eller O-glykosylering til serin, som finner sted i cellene Golgi-apparatet. Sukkeret er bundet til en hydroksylgruppe av serinet. Glykoproteinverdiene er spesielt relevante i forhold til plasmaproteiner, ettersom de spiller en rolle i et komplett blodopptak. Å liste opp alle normale verdier for glykoproteiner hver for seg på dette tidspunktet vil overskride omfanget.
Sykdommer og lidelser
Noen genetiske sykdommer har innvirkning på glykosylering. En gruppe av slike sykdommer er CDG. Glykoproteinene viser unormale verdier. De berørte lider av nedsatt utvikling, som angår både fysiske og mentale problemer.
Squint kan være et annet symptom på den genetiske lidelsen. Totalt rundt 250 forskjellige gener er involvert i dannelsen av glokoproteiner. Ved medfødte glykosyleringsforstyrrelser skyldes forstyrrelser i tilknytning av karbohydrat-sidekjeder til proteiner genetisk disposisjon. I modifiseringen etter translasjonen får proteiner sin fulle funksjonalitet. I denne prosessen, når enzymer eller proteiner som bygger karbohydrat-sidekjeder unormalt settes sammen, opprettes CDG. N-glykosylering påvirkes oftest av lidelser. Til dags dato er det oppdaget rundt 30 enzymdefekter som har innvirkning på N-glykosylering.
Genetiske O-glykosyleringsforstyrrelser er noe sjeldnere. De manifesterer seg i nevromuskulære sykdommer i flere systemer som Walker-Warburg syndrom. Siden glykoproteiner har så mange funksjoner i organismen, er det kliniske bildet preget av en rekke symptomer. Alle organsystemer kan påvirkes av medfødte glykosyleringsforstyrrelser. Psykomotoriske utviklingsforstyrrelser er hovedsymptomet. Nevrologiske avvik er like vanlig. Koagulasjonsforstyrrelser eller endokrine lidelser er heller ikke uvanlig.


.jpg)




.jpg)